概要
- 二酸化塩素(ClO2)について
-
二酸化塩素(ClO2)の特徴は、他の塩素と比較して化学構造的に安定であり、アンモニア、フェノール類及びフミン酸と反応せず、クロラミン、クロロフェノール類及びトリハロメタンを生成しないことです。
また、ClO2は塩素のようにpH値の上昇による殺菌力の低下がみられず、広範囲なpH領域での有効性が認められています。
ClO2はガス化しやすく、解放系では挿散しやすく、pH7、20℃、1時間で1~1.5mg/R揮散します。このような特徴を持っている二酸化塩素(ClO2)も、従来は、貯蔵の困難性や発生装置が必要なことなどから、その用途はかなり限定されていました。
- 安定二酸化塩素[NaClO2]について
-
しかし、近年アメリカにおいて二酸化塩素をアルカリ性水溶液に溶存させて安定させる方法が研究開発され、安全で殺菌消毒、脱臭、防腐等の効果が証明され誰にでも手軽に使用できるようになりました。
一般的には、「安定化二酸化塩素」と呼ばれています。私たちが販売する「安定化二酸化塩素」剤は、原液濃度は5%・pH9±0.3のものです。
- 安定化二酸化塩素溶液の物性は次のとおりです
-
ClO2(5~50℃における濃度):5%(50,000ppm)
比重20/20℃:1.090~1.120
沸点:101.1℃
融点:5.56℃
pH:9.0±0.3
炭酸ナトリウム(Na2CO3 and NaHCO3):3.65%(安定剤として)
水分(H2O):91.35%
ClO2:5.0%
安定性:暗所18ケ月の保存で、ClO2の損失は0.1%以下
可溶性:易水溶性
腐食性:原液は金属を多少腐食するが、通常の使用状態では金属に対する腐食性なし
外観:無色ないし微淡黄色透明
臭気:無臭または微かにオゾンよう臭気あり
安定化二酸化塩素の殺菌消毒のメカニズム
-
微生物と安定化二酸化塩素の殺菌消毒のメカニズムは、通常の塩素剤と基本的に異なります。通常の 塩素剤には、塩素酸ナトリウム、過塩素酸ナトリウム、サラシ粉、次亜塩素酸ナトリウム、などがあり ますが、これらはすべて塩素イオン(Cl-)により殺菌消毒がされます。
そのために、水中などに有機 物があればトリハロメタンなどの塩素化合物が副生成されます。
しかし、安定化二酸化塩素のそれは、有機物例えば蛋白質(アミノ酸が20数種額結合したもので、硫黄(S)や芳香環を持っている)のジサルファイド結合(-S-S-)に、ClO2 の酸素原子(O)が反応し、(注1)の構造に変化し固定化されます。要約すれば酸素原子の酸化力により、病原菌(蛋白質が主成分)の殺菌消毒、有機物の腐敗を防いで 防腐の働きをしています。したがって、水の消毒に[Na ClO2〕を使用しても塩素剤のようにトリハロメタンのような有害な塩素化合物は生成されません。
- 参考
-
①消毒とは、病原微生物を殺すか、または除去して感染力を無くすことです。
②感染とは、病原体が人や動物・植物の体内に侵入して、発育あるいは増殖しはじめた状態を言います。
③防腐とは、微生物を積極的に殺さなくても、発育を阻止し、目的のものを変化させないよう保つことで、薬品の添加、乾燥、冷蔵などの方法があります。
安定化二酸化塩素の殺菌消毒力(除菌力)
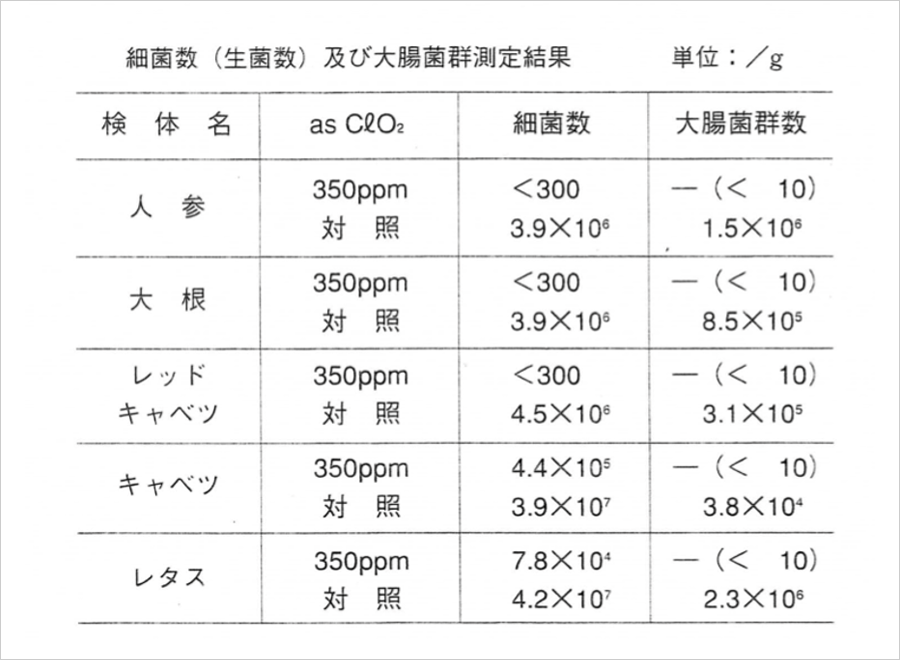
テストでは、安定化二酸化塩素の355ppm・pH4に(水酢酸で調整)調整した水溶液を用いて、細菌類、糸状菌療(カビ類など)、大腸菌群、黄色ブドウ球菌などを短時間で殺菌消毒しています。安定化二酸化塩素の水溶液を殺菌消毒に使用する場合に、5%の原液を所定の濃度に希釈し、氷酢酸ま たは希塩酸などでpH値を4前後に調整すると即効性が得られます。
現在、私たちの生活の身近であるアルコール除菌の50万倍、次亜塩素酸の10倍(ガスを発生しません)ともの能力があると言われています。
ウイルスは外殻がタンパク質で生成されているため酸化されやすい。
アルコールで手を洗うことや布巾でテーブルを拭くことは直接触れる部分はウイルスを取り除けてもテーブルの裏側など布巾で拭けない場所は取り除けない。これらの実験のいくつかを紹介します。
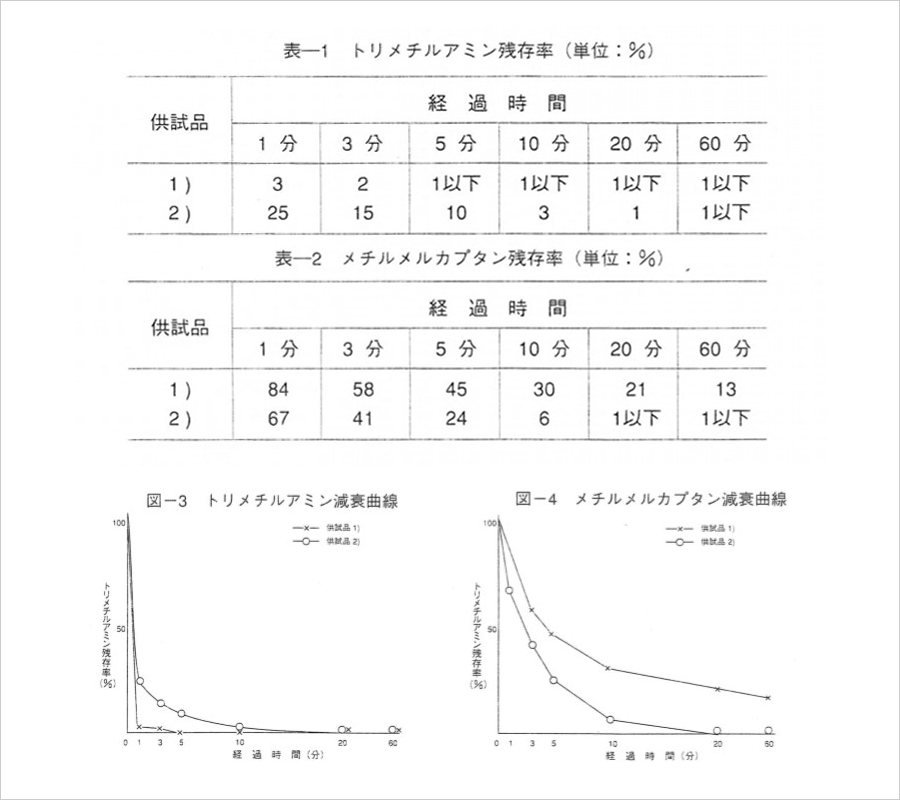
安定化二酸化塩素の消臭力
(社)日本食品分析センターに依頼して、安定化二酸化塩素液剤をゲル状基剤に含ませてClO2ガスを放出して悪臭成分を除去した実験結果を紹介します。
1)供試品 1)ClO2ゲル5,000ppm(KW)・2)ClO2ゲル5,000ppm(YN)
2)試験日的トリメチルアミンおよびメチルメルカブタンを用いて消臭効果試験を行う。
3)試験結果対照に対する残存率を求めた結果は次のとおりであった(図-3、4参照)。
浮遊菌に対しての試験データ
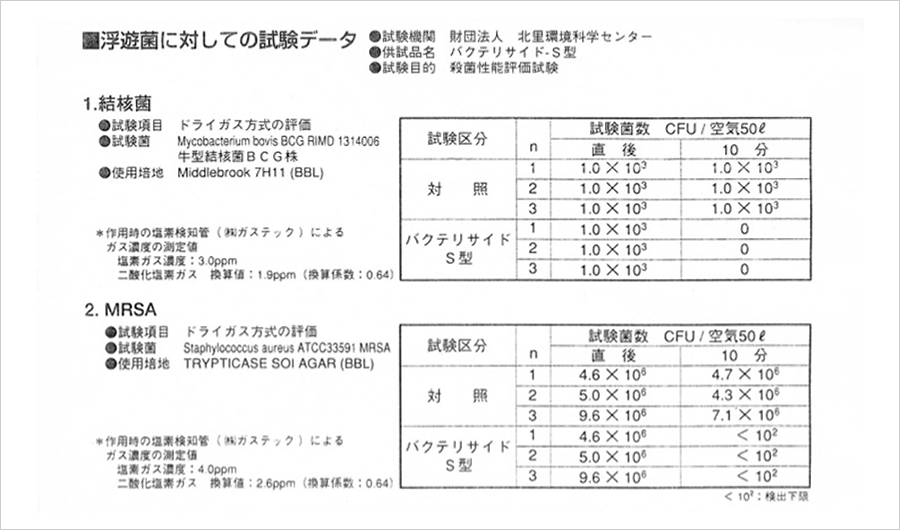
水溶液の殺菌効果試験データ

安定化二酸化塩素の安全性
自然発火:なし
通常の火災と爆発の危険性:なし